Étude de la glycosyltransférase Aah
lundi 15 juin 2009
Nous étudions les propriétés de la glycosyltransférase Aah. Nous purifions la protéine, la caractérisons par plusieurs techniques biochimiques et biophysiques et nous reconstituons son activité in vitro.

Mécanisme de l’adhésion médiée par AIDA-I
mardi 2 juin 2009
Nous cherchons à identifier le ou les molécules de l’hôte qui sont reconnues par AIDA-I. Pour cela nous utilisons des approches biochimiques. Les candidats sont ensuite validé par des études plus poussées.

Mécanisme de l’auto-agrégation
lundi 1 juin 2009
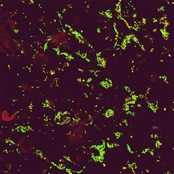
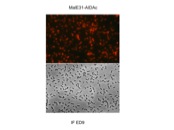
Pour comprendre le mécanisme d’auto-agrégation nous avons étudié les interactions AIDA-AIDA. Pour cela nous utilisons des techniques biochimiques, biophysiques et de biologie moléculaire. Nous avons ainsi montré que AIDA interagit effectivement avec elle même et que cette association est influencée par la concentration en sel.

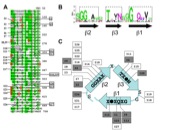
Relations structure-fonction: TibA
samedi 2 mai 2009
Après l’étude que nous avons faite pour AIDA-I, une approche similaire est mise en oeuvre pour TibA.

Relations structure-fonction: AIDA-I
vendredi 1 mai 2009
AIDA-I a de multiples domaines et, outre sa fonction d’adhésion, possède une activité auto-protéolytique ainsi que la faculté de promouvoir l’auto-agrégation bactérienne et la formation de biofilms. Nous cherchons à étudier chaque domaine, en déterminer son organisation ou sa structure en identifiant les acides aminés clés, et en étudier l’activité.

Inhibition de l’adhésion médiée par AIDA-I
mercredi 15 avril 2009
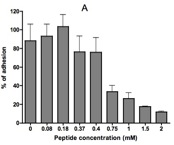
Nous avons sélectionné par la technique de Phage Display des peptides capables de se fixer à AIDA-I. Ces peptides sont capables de prévenir l’adhésion à des cellules épithéliales médiée par AIDA-I.

Étude de la biogenèse: Clivage
vendredi 3 avril 2009
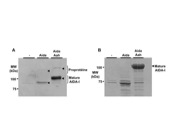
AIDA-I et Ag43 (mais pas TibA) sont retrouvées clivées dans la membrane externe. Nous nous intéressons au mécanisme de clivage et nous avons montré que AIDA-I se clive de façon auto-catalytique grâce à deux acides aminés portant des groupements carboxyls catalytiques. Le clivage est de plus étroitement couplé au repliement de la protéine.

Étude de la biogenèse: Glycosylation
jeudi 2 avril 2009
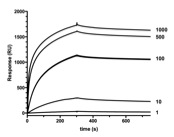
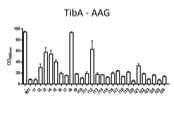
AIDA-I et TibA sont gycosylées par des enzymes spécifiques, Aah et TibC. Nous cherchons à comprendre le mécanisme de ces enzymes et à quoi sert la glycosylation.

Étude de la biogenèse: Sécrétion
mercredi 1 avril 2009
L’adhésine que nous étudions est une protéine afimbriale. Elle est ancrée dans la membrane externe par un domaine adoptant une structure en tonneau et qui participe aussi à sa translocation à travers la membrane externe. Nous cherchons à comprendre quelles sont les étapes clés dans la translocation de l’adhésine et, par exemple, identifier les acides aminés dans le domaine en tonneau qui

Identifications d’allèles de aida
lundi 2 mars 2009
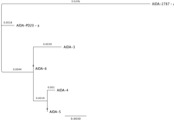
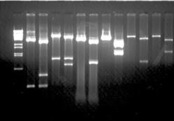
À partir d’une banque d’isolats cliniques de souches d’Escherichia coli causant des diarrhées post-sevrage chez le porc, nous avons isolés 10 allèles différents de aida, correspondant à des virotypes différents. Nous séquençons ces allèles et étudions les relations entre les séquences.

Étude de la régulation de : aida
dimanche 1 mars 2009
Nous avons cloné et séquencé la région non-codante située en amont de l’opéron aah-aida. Dans cette région nous avons identifié des promoteurs putatifs et des sites de liaisons pour des facteurs de transcriptions. Il faut maintenant tester les conditions régulant l’expression de ce promoteur. Une fusion transcriptionelle à la GFP a été construite à cet effet et nous faisons des mesures par qRT-

Mise en place du système: purification
lundi 2 février 2009
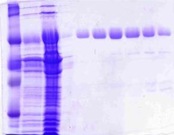
Nous utilisons plusieurs techniques de chromatographie pour purifier les protéines que nous étudions.
- Chromatographie échangeuse d’ions
- Chromatographie d’affinité (nous avons placés des tags poly-histidines sur les protéines que nous étudions)
- Chromatographie d’exclusion de taille
Toutes nos purifications sont effectuées avec une HPLC Purifier 10 de Akta (GE Biosciences).

Mise en place du système: clonage
dimanche 1 février 2009
Afin d’étudier une adhésine d’E. coli, nous devons mettre au point des systèmes d’expression contrôlés de cette protéine. Pour cela nous clonons le gène codant pour l’adhésine à partir de souches pathogènes et l’insérons dans des vecteurs d’expression pour des souches bactériennes non pathogènes. Nous développons ensuite des stratégies de purification et des tests fonctionnels de l’adhésine qui

Contexte: Self Associating Autotransporters
vendredi 2 janvier 2009
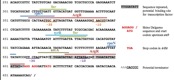
AIDA-I appartient à une sous-famille de transporteurs qui ont pour particularité d’avoir dans leurs parties N-terminale un motif imparfaitement répété de 19 amino acides:
-GG-A--T-(I/L/V)N-GG-(Q/L)-(V/I/L)-
Ce motif est caractéristique. De plus les membres de la famille permettent tous aux bactéries les exprimant (dans certaines conditions) de former des agrégats. Il a été donc

Contexte: Adhesin Involved in Diffuse Adherence
jeudi 1 janvier 2009
AIDA-I est une adhésine afimbriale identifiée en 1989 par le groupe de Michael Alexander Schmidt (Univ. Muenster). Elle a été clonée à partir d’une souche d’Escherichia coli isolée d’un cas de diarrhée infantile. Depuis le gène codant pour cette adhésine (aida) a été retrouvé surtout dans des souches pathogènes isolées de cas de diarrhèes post-sevrage chez le porc.


Nous étudions une famille d’adhésines qui sont présentes dans des souches pathogènes d’Escherichia coli. Cette famille a été baptisée ‘Self-Associating Autotransporters’